- Un “ grupo funcional ” es un átomo o conjunto de átomos que le confieren a la molécula características específicas. Todas las moléculas que presenten un mismo “ grupo funcional ”, actuarán químicamente de manera similar.
- Se entiende por grupo funcional un conjunto de átomos presente en la cadena de carbono de un compuesto y que por sus características de reactividad define el comportamiento químico de la molécula. Cada grupo funcional definirá, por tanto, un tipo distinto de compuesto orgánico . El conjunto de compuestos orgánicos que contienen el mismo grupo funcional constituye una familia de compuestos .
- El grupo funcional principal determina: el nombre del compuesto la cadena carbonada principal, que debe ser la más larga posible que contenga la función principal La localización de los sustituyentes y funciones secundarias.
Alcoholes
Alcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos.Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatrotetrioles y así sucesivamente
Cetona
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.1 Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendocetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno.
El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones porefecto inductivo.
Aldehídos
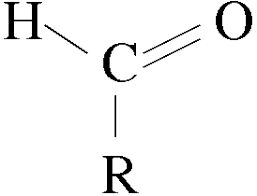
Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al :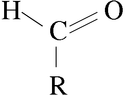 Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.Se pueden obtener a partir de la oxidación suave de los alcoholes primarios. Esto se puede llevar a cabo calentando el alcohol en una disolución ácida de dicromato de potasio (también hay otros métodos en los que se emplea Cr en el estado de oxidación +6). El dicromato se reduce a Cr3+ (de color verde). También mediante la oxidación de Swern, en la que se emplea dimetilsulfóxido, (DMSO), dicloruro de oxalilo, (CO)2Cl2, y una base
Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.Se pueden obtener a partir de la oxidación suave de los alcoholes primarios. Esto se puede llevar a cabo calentando el alcohol en una disolución ácida de dicromato de potasio (también hay otros métodos en los que se emplea Cr en el estado de oxidación +6). El dicromato se reduce a Cr3+ (de color verde). También mediante la oxidación de Swern, en la que se emplea dimetilsulfóxido, (DMSO), dicloruro de oxalilo, (CO)2Cl2, y una base
Acidos Carboxilicos
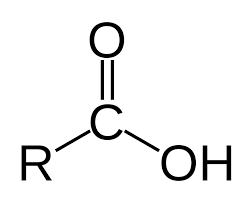
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.Los derivados de los ácidos carboxílicos tienen como formula general R-COOH. Tiene propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones, una ruptura heterolítica cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
Eteres
La nomenclatura de los éteres consiste en nombrar las cadenas carbonadas por orden alfabético y terminar el nombre con la palabra éter (dimetiléter).
Propiedades físicasSon compuestos de gran estabilidad, muy usados como disolventes inertes por su baja reactividad. Los éteres corona complejan los cationes eliminándolos del medio, permitiendo la disolución de sales en disolventes orgánicos.
Síntesis de éteresSe obtienen por reacción de haloalcanos primarios y alcóxidos, llamada síntesis de Williamson. También se pueden obtener mediante reacción SN1 entre alcoholes y haloalcanos secundarios o terciarios. Un tercer método consiste en la condensación de dos alcoholes en un medio ácido.
Esta reacción va a temperaturas moderadas si uno de los alcoholes es secundario o terciario, en el caso de que ambos sean primarios requiere temperaturas de 140ºC.
Los éteres cíclicos se forman por sustitución nucleófila intramolecular y los ciclos mas favorables son de 3, 5 y 6.
Éteres como grupos protectoresLa escasa reactividad de los éteres se puede aprovechar para utilizarlos como grupos protectores. Son muy estables en medios básicos y nucleófilos, lo que permite proteger alcoholes, aldehídos y cetonas transformándolos en éteres. La desprotección ser realiza en medio ácido acuoso.
Esteres
Los ésteres dan sabor y olor a muchas frutas y son los
constituyentes mayoritarios de las ceras animales y vegetales.Todas las grasas y aceites naturales (exceptuando los
aceites minerales) y la mayoría de las ceras son mezclas de ésteres. Por
ejemplo, los ésteres son los componentes principales de la grasa de res (sebo),
de la grasa de cerdo (manteca), de los aceites de pescado (incluyendo el aceite
de hígado de bacalao) y del aceite de linaza.
Los ésteres de alcohol cetílico se encuentran en el
espermaceti, una cera que se obtiene del esperma de ballena, y los ésteres de
alcohol miricílico en la cera de abeja. La nitroglicerina,
un explosivo importante, es el éster del ácido nítrico y la glicerina. Los
ésteres como el etanoato de isoamilo (aceite de plátano), el etanoato de etilo
y el etanoato de ciclohexanol, son los principales disolventes en las
preparaciones de lacas. Otros ésteres, como el ftalato de dibutilo y el fosfato
de tricresilo se usan como plastificadores en las lacas. El etanoato de amilo
se emplea como cebo odorífero en venenos para la langosta, y algunos de los
metanoatos son buenos fumigantes. Los ésteres tienen también importancia en
síntesis orgánica.Aromas artificialesMuchos de los ésteres de bajo peso molecular tienen
olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato
de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la
fabricación de aromas y perfumes sintéticos.Aditivos AlimentariosEstos mismos ésteres de bajo peso molecular que tienen
olores característicos a fruta se utilizan como aditivos alimentarios, por
ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.Estos mismos ésteres de bajo peso molecular que tienen
olores característicos a fruta se utilizan como aditivos alimentarios, por
ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.Los compuestos de
esta función química se forman por la reacción de un ácido y un alcohol, al
sustituir el H del ácido orgánico por una cadena hidrocarbonada.
Aminas
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente.Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos. Los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y los que tienen tres, aminas terciarias.Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina.
Amidas
Una amida es un compuesto orgánico que consiste en una Amina unida a un Acido Carboxilico convirtiendose en una Amina acida (o amida). Por esto su grupo funcional es del tipo RCONH'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente.Concretamente se pueden sintetizar a partir de un ácido carboxílico y una aminaTodas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. Las amidas también se utilizan mucho en la industria farmacéutica.
Formula
Estructura
Prefijo
Sufijo
Ejemplo
Alcohol
R-OH

hidroxi-
-ol

Cetona
R-C(=O)-R'

oxo-
-ona

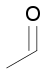
Aldehídos
R-C(=O)H
formil-
Ácidos Carboxílicos
R-COOH
carboxi-
Ácido -ico

Eteres
R-O-R'
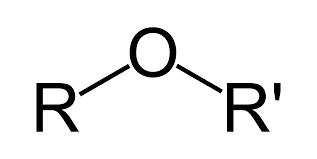
-oxi-
R-il R'-il éter

Esteres
R-COO-R'
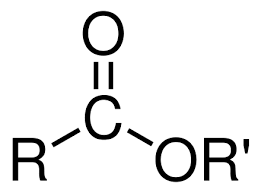
-iloxicarbonil-
R-ato de R'-ilo
Aminas
R-NH2

amino-
-amina

Amidas
R-C(=O)N(-R')-R"

amino-
-amina

- http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l1/gfunc.html
- http://cienciasnaturales.es/GRUPOSFUNCIONALES.swf
Alcoholes
Alcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos.Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatrotetrioles y así sucesivamente
Cetona
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.1 Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendocetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno.
El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones porefecto inductivo.
Aldehídos
Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al : Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.Se pueden obtener a partir de la oxidación suave de los alcoholes primarios. Esto se puede llevar a cabo calentando el alcohol en una disolución ácida de dicromato de potasio (también hay otros métodos en los que se emplea Cr en el estado de oxidación +6). El dicromato se reduce a Cr3+ (de color verde). También mediante la oxidación de Swern, en la que se emplea dimetilsulfóxido, (DMSO), dicloruro de oxalilo, (CO)2Cl2, y una base
Es decir, el grupo carbonilo C=O está unido a un solo radical orgánico.Se pueden obtener a partir de la oxidación suave de los alcoholes primarios. Esto se puede llevar a cabo calentando el alcohol en una disolución ácida de dicromato de potasio (también hay otros métodos en los que se emplea Cr en el estado de oxidación +6). El dicromato se reduce a Cr3+ (de color verde). También mediante la oxidación de Swern, en la que se emplea dimetilsulfóxido, (DMSO), dicloruro de oxalilo, (CO)2Cl2, y una base
Acidos Carboxilicos
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.Los derivados de los ácidos carboxílicos tienen como formula general R-COOH. Tiene propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones, una ruptura heterolítica cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
Eteres
La nomenclatura de los éteres consiste en nombrar las cadenas carbonadas por orden alfabético y terminar el nombre con la palabra éter (dimetiléter).
Propiedades físicasSon compuestos de gran estabilidad, muy usados como disolventes inertes por su baja reactividad. Los éteres corona complejan los cationes eliminándolos del medio, permitiendo la disolución de sales en disolventes orgánicos.
Síntesis de éteresSe obtienen por reacción de haloalcanos primarios y alcóxidos, llamada síntesis de Williamson. También se pueden obtener mediante reacción SN1 entre alcoholes y haloalcanos secundarios o terciarios. Un tercer método consiste en la condensación de dos alcoholes en un medio ácido.
Esta reacción va a temperaturas moderadas si uno de los alcoholes es secundario o terciario, en el caso de que ambos sean primarios requiere temperaturas de 140ºC.
Los éteres cíclicos se forman por sustitución nucleófila intramolecular y los ciclos mas favorables son de 3, 5 y 6.
Éteres como grupos protectoresLa escasa reactividad de los éteres se puede aprovechar para utilizarlos como grupos protectores. Son muy estables en medios básicos y nucleófilos, lo que permite proteger alcoholes, aldehídos y cetonas transformándolos en éteres. La desprotección ser realiza en medio ácido acuoso.
Esteres
Los ésteres dan sabor y olor a muchas frutas y son los
constituyentes mayoritarios de las ceras animales y vegetales.Todas las grasas y aceites naturales (exceptuando los
aceites minerales) y la mayoría de las ceras son mezclas de ésteres. Por
ejemplo, los ésteres son los componentes principales de la grasa de res (sebo),
de la grasa de cerdo (manteca), de los aceites de pescado (incluyendo el aceite
de hígado de bacalao) y del aceite de linaza.
Los ésteres de alcohol cetílico se encuentran en el
espermaceti, una cera que se obtiene del esperma de ballena, y los ésteres de
alcohol miricílico en la cera de abeja. La nitroglicerina,
un explosivo importante, es el éster del ácido nítrico y la glicerina. Los
ésteres como el etanoato de isoamilo (aceite de plátano), el etanoato de etilo
y el etanoato de ciclohexanol, son los principales disolventes en las
preparaciones de lacas. Otros ésteres, como el ftalato de dibutilo y el fosfato
de tricresilo se usan como plastificadores en las lacas. El etanoato de amilo
se emplea como cebo odorífero en venenos para la langosta, y algunos de los
metanoatos son buenos fumigantes. Los ésteres tienen también importancia en
síntesis orgánica.Aromas artificialesMuchos de los ésteres de bajo peso molecular tienen
olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato
de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la
fabricación de aromas y perfumes sintéticos.Aditivos AlimentariosEstos mismos ésteres de bajo peso molecular que tienen
olores característicos a fruta se utilizan como aditivos alimentarios, por
ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.Estos mismos ésteres de bajo peso molecular que tienen
olores característicos a fruta se utilizan como aditivos alimentarios, por
ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.Los compuestos de
esta función química se forman por la reacción de un ácido y un alcohol, al
sustituir el H del ácido orgánico por una cadena hidrocarbonada.
Aminas
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo. Según se sustituyan uno, dos o tres hidrógenos, las aminas serán primarias, secundarias o terciarias, respectivamente.Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes. Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos. Los que tienen un solo grupo se llaman aminas primarias, los que tienen dos se llaman aminas secundarias y los que tienen tres, aminas terciarias.Cuando se usan los prefijos di, tri, se indica si es una amina secundaria y terciaria, respectivamente, con grupos o radicales iguales. Cuando se trata de grupos diferentes a estos se nombran empezando por los más pequeños y terminando con el mayor al que se le agrega la terminación amina.
Amidas
Una amida es un compuesto orgánico que consiste en una Amina unida a un Acido Carboxilico convirtiendose en una Amina acida (o amida). Por esto su grupo funcional es del tipo RCONH'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente.Concretamente se pueden sintetizar a partir de un ácido carboxílico y una aminaTodas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. Las amidas también se utilizan mucho en la industria farmacéutica.
Formula
|
Estructura
|
Prefijo
|
Sufijo
|
Ejemplo
|
|
Alcohol
|
R-OH
|
hidroxi-
|
-ol
|

|
|
Cetona
|
R-C(=O)-R'
|
oxo-
|
-ona
|

|
|
Aldehídos
|
R-C(=O)H
|
formil-
|
|
 |
|
Ácidos Carboxílicos
|
R-COOH
|
carboxi-
|
Ácido -ico
|

|
|
Eteres
|
R-O-R'
|
-oxi-
|
R-il R'-il éter
|

|
|
Esteres
|
R-COO-R'
|
-iloxicarbonil-
|
R-ato de R'-ilo
|

|
|
Aminas
|
R-NH2
|

|
amino-
|
-amina
|

|
Amidas
|
R-C(=O)N(-R')-R"
|

|
amino-
|
-amina
|

|
- http://www.quimicaorganica.org/acidos-carboxilicos/index.php
-
http://www.quimicaorganica.org/eteres-teoria/eteres-propiedades-fisicas.html
http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-04.pdf
http://www.quimicaorganica.org/eteres-teoria/eteres-propiedades-fisicas.html
http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-04.pdf
No hay comentarios:
Publicar un comentario